AGUÁ SANITÁRIA . . . AMACIANTE . . . SABÃO
AGUÁ SANITÁRIA . . . AMACIANTE . . . SABÃO ( barra & liquido feito com óleo usado doméstico). Um pequeno exemple das composições:
Composição química da água sanitária
A composição química da água sanitária é basicamente hipoclorito de sódio ou de cálcio em solução com uma proporção de “cloro ativo” de cerca de 2,5%.
A composição química da água sanitária (lixívia ou barrela) é basicamente uma solução aquosa de hipoclorito de sódio (NaClO), cuja fórmula está representada a seguir:
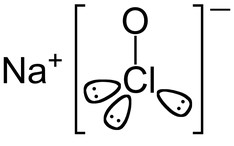
Fórmula do hipoclorito de sódio
Em condições ambientes, o hipoclorito é um sólido branco na forma de pó. Nessa forma, muitas vezes o hipoclorito de sódio é chamado simplesmente de “cloro”, “cloro ativo” ou “cloro líquido”, porém, essas terminologias estão erradas, pois sua composição não é Cl2.
Na realidade, a solução de hipoclorito de sódio que forma a água sanitária é obtida borbulhando-se o cloro (Cl2) em uma solução de hidróxido de sódio (NaOH – soda cáustica), ocorrendo a seguinte reação:
2 NaOH + Cl2 → NaCl + NaClO + H2O
O hipoclorito de sódio pode ser obtido também por meio da eletrólise aquosa do cloreto de sódio (NaCl – sal de cozinha). Visto que esse sal sofre dissociação iônica em meio aquoso, haverá no meio os seguintes íons: Na+ e Cl-, vindos do sal, e OH- e H+, da água.
Entre esses íons, os menos reativos são o H+ e o Cl-, portanto, são eles que descarregam no cátodo e no ânodo, respectivamente. Veja as reações envolvidas nessa eletrólise em meio aquoso:
.jpg)
Esquema de processo de eletrólise da salmoura e reação global
Observe que a eletrólise de uma solução aquosa de NaCl produz soda cáustica (NaOH), gás hidrogênio (H2) e gás cloro (Cl2). Portanto, o NaClO pode ser produzido industrialmente pela eletrólise de uma solução de cloreto de sódio sem nenhuma separação entre o cátodo e o ânodo, mantendo-os resfriados.
A água sanitária pode ser composta de hipoclorito de cálcio também, pois, conforme veremos mais adiante, as suas principais propriedades são oriundas do ânion hipoclorito (ClO-). Essas soluções apresentam 2,0 a 2,5% p/p de teor de cloro ativo durante o prazo de validade, que é, no máximo, de seis meses.
A água sanitária é uma solução aquosa de cor levemente amarelada, como mostra a imagem a seguir. É também fotossensível, ou seja, decompõe-se sob ação da luz (por isso sua embalagem costuma ser escura ou opaca), é corrosiva a metais e, quando em contato com ácidos, libera gases tóxicos.

Água sanitária líquida de cor levemente amarelada
Esse produto possui duas aplicações principais: como desinfetante e como alvejante. Veja por que a água sanitária tem essas duas propriedades:
* Desinfetante: Em água, o hipoclorito de sódio dissocia-se facilmente, formando o ânion hipoclorito, ClO-, que atua como desinfetante e bactericida:
NaClO(s) ↔ Na+(aq) + ClO-(aq)
Esse íon pode também reagir com as moléculas de água e formar o ácido hipocloroso:
ClO-(aq) + H2O(l) ↔ HClO(aq) + OH-(aq)
Esse ácido atua também como desinfetante e bactericida, sendo 80 vezes mais eficiente que o ânion hipoclorito.
Assim, a água sanitária é um poderoso antisséptico usado em limpeza doméstica e de hospitais. Ela age destruindo ou inativando micro-organismos patogênicos, algas e bactérias de vida livre.
A água sanitária usada para limpeza doméstica possui uma concentração de “cloro ativo” de 25 g/L a 50 g/L. Mas existem outras soluções de hipoclorito de sódio, que se diferenciam somente quanto à concentração, que são usadas para tratamento da água e limpeza. Veja as concentrações recomendadas para cada finalidade:
- Água para beber: 0,4 mg/L (basta adicionar duas gotas de solução de hipoclorito de sódio a 2,5% em um litro de água e aguardar 10 minutos que ela estará própria para consumo);
- Para limpar vegetais: 4 mg/L (você pode adicionar 10 gotas de solução de hipoclorito de sódio a 2,5% em um litro de água e deixar o vegetal mergulhado por cerca de 30 minutos que todos os micro-organismos presentes serão destruídos, evitando, assim, doenças como a cólera);
- Limpeza de utensílios: 8 mg/L;
* Alvejante: A água sanitária é usada também como branqueadora na lavagem doméstica de roupas. Isso acontece porque tanto o íon hipoclorito quanto o ácido hipocloroso são poderosos oxidantes de compostos orgânicos e inorgânicos.
Resumidamente, isso acontece porque as cores são vistas por meio do movimento dos elétrons que saltam entre as camadas de energia nos átomos. Assim, os alvejantes, como são agentes oxidantes, retiram esses elétrons, e a cor do tecido “desaparece”.
Em escala industrial, o hipoclorito de cálcio é mais usado para o tratamento de papel e tecidos.
Composição química da amaciante:
Composição do amaciante de roupas da Ypê aconchego com Hidrocerâmidas Composição:
Tensoativo Catiônico
Ceramidas
Conservantes
Umectante
Corante
Opacidificante
Fragância
Água
Componente Ativo:
Cloreto de Dialquil Dimetil Amônio
Composição química do sabão:
O sabão é constituído de um sal derivado de ácidos carboxílicos. Os sais de ácido carboxílico caracterizam-se pela presença do ânion carboxilato, que é mostrado a seguir:
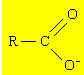
Ânion carboxilato - grupo funcional dos sais orgânicos derivados de ácidos carboxílicos
“R” é um radial alquila que, no caso dos sabões, é sempre uma cadeia bastante longa, em geral com 12 ou mais átomos de carbono.
A reação química que dá origem a esses sais de ácido carboxílico são reações de saponificação, que nada mais são do que uma hidrólise alcalina, ou seja, um triéster (triglicerídeo) reage com uma base em meio aquoso e forma um sal, que é o sabão, e um poliálcool.
Os triglicerídeos possuem longas cadeias porque eles são derivados de ácidos graxos, isto é, ácidos carboxílicos com mais de onze carbonos. Três ácidos carboxílicos reagem com o glicerol (glicerina) e originam o triglicerídeo, como mostrado a seguir:
.jpg)
Reação genérica de formação do triglicerídeo a partir de três ácidos graxos e uma glicerina
Em geral, os triglicerídeos são obtidos principalmente de óleos e gorduras. Assim, na reação de saponificação, coloca-se alguma gordura ou óleo para reagir com uma base, que geralmente é a soda cáustica (hidróxido de sódio, NaOH), em meio aquoso, formando um sal de ácido carboxílico, que é o nosso sabão, e o poliálcool, que é a glicerina:
.jpg)
Reação de saponificação para fabricação de sabão
Um exemplo de sabão obtido por esse método é o estereato de sódio (C17H35COO-Na+):
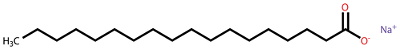
Fórmula do estereato de sódio, um sabão
Os sabões mais duros são os que possuem o sódio e são usados para limpeza comum. Para a obtenção de sabões mais moles, utiliza-se o hidróxido de potássio (KOH) no lugar do hidróxido de sódio (NaOH) na reação de saponificação. Os sabões de barra utilizam a gordura animal como matéria-prima, enquanto os sabonetes que usamos para a higiene pessoal são feitos com óleos vegetais no lugar da gordura.
Observe na composição química do sabão que suas moléculas sempre possuem uma cadeia carbônica bem longa, que é apolar, e uma extremidade polar. É por essa razão que os sabões conseguem limpar a gordura e a sujeira.
.jpg)
Estrutura típica de um sabão
O sabão funciona da seguinte maneira: a sua parte apolar é hidrofóbica, ou seja, tem aversão à água, mas é lipofílica, isto é, interage com as moléculas da gordura (que também são apolares), "aprisionando-as" dentro de uma micela, como mostra a imagem a seguir. Enquanto isso, as extremidades polares das moléculas do sabão, que são hidrofílicas, ficam voltadas para fora, interagindo com a água. Desse modo, a sujeira gordurosa é arrastada com a água.
Os sabões são também chamados de agentes tensoativos ou surfactantes(do inglês surface active agents =surfactants), pois eles diminuem a tensão superficial da água, ajudando a penetrar melhor nos materiais e a realizar a sua limpeza.
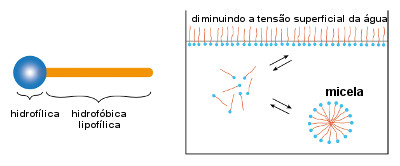
Ilustração de como o sabão funciona
A tensão superficial da água é aquela "película" que se forma em sua superfície em razão das ligações de hidrogênio entre suas moléculas. Alguns insetos, por exemplo, conseguem caminhar sobre as águas em razão dessa tensão superficial. Objetos leves, como um clipe, também ficam flutuando na superfície da água. Mas se a água estiver com sabão, essa tensão superficial é desfeita e o clipe afunda.
Deixe sua ESCOLA limpa e aconchegante; com economia. O PROJETO: Lixo, não encha o saco! realiza as oficinas.
Visite nossa pagina no Facebook:
https://www.facebook.com/KACE69
Maiores Informações: (93) 99214-0910
Por: André Oliveira


















Nenhum comentário
Postar um comentário